 新潟大学自の研究グループは,イネ種子の澱粉代謝において重要な働きをするα-アミラーゼの立体構造を解くことに成功した(ニュースリリース)。
新潟大学自の研究グループは,イネ種子の澱粉代謝において重要な働きをするα-アミラーゼの立体構造を解くことに成功した(ニュースリリース)。
イネは日本を含むアジアにおける主食として,世界人口の半数以上が食べていると言われることから,学術的にもそして食料という観点からも重要な研究対象のひとつ。しかしながら,イネのα-アミラーゼの立体構造はこれまで不明であった。
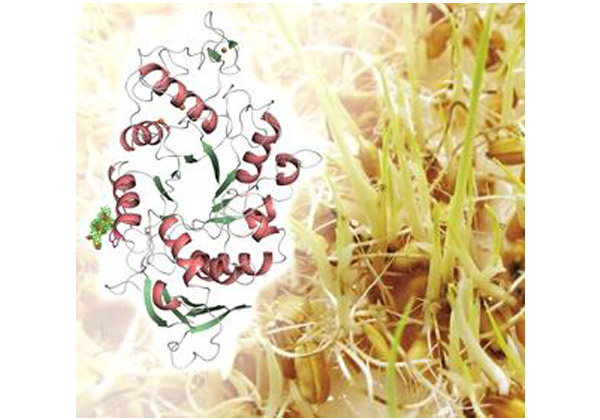
今回,研究グループは,イネの主要α-アミラーゼであるAmyI-1タンパク質の立体構造を,X線結晶構造解析を用いて解明し,AmyI-1は,α-ヘリックスとβ-シートとよばれる2次構造が同心円状に配置した,(β/α)8-barrel構造を有していることが分かった。
また,Gly-72やLeu-321などのアミノ酸残基を含む活性中心の構造や,Asn-263, Thr-307, Asn-342, Pro-373, Ala-374などのアミノ酸残基から構成されるN結合型糖鎖の結合サイト付近の構造は,他の生物種由来のアミラーゼとは異なる,AmyI-1に特有の構造であることを明らかにした。
AmyI-1はイネの澱粉代謝の主要酵素であり,その構造生物学的理解は学術的に大きな意義がある。一方で,最近の研究で温暖化による高温ストレスによりα-アミラーゼの働きが異常に高まり,それが原因で米の品質低下を引き起こすことが明らかになっている。また,米に含まれるα-アミラーゼは酒の個性を生み出す因子と考えられる。今回の研究成果は,今後,米品質改善や酒の個性化といった応用研究への展開が期待されるとしている。
関連記事「京大ら,コムギのゲノム配列の概要解読に成功」「農工大ら,多収イネの光合成能力に貢献する遺伝子を特定」「NIAS,イネの高温耐性に関わる遺伝領域を解明しDNAマーカーを開発」































