 東京工業大学と東京大学は共同で,光に応答して遺伝子を細胞に導入することができるナノマシンを開発し,ナノマシンの全身投与後にがんに光を照射することで,がんへの光選択的な遺伝子導入に世界で初めて成功した(ニュースリリース)。
東京工業大学と東京大学は共同で,光に応答して遺伝子を細胞に導入することができるナノマシンを開発し,ナノマシンの全身投与後にがんに光を照射することで,がんへの光選択的な遺伝子導入に世界で初めて成功した(ニュースリリース)。
遺伝子に異常を持つ細胞に,タンパク質の設計図であるDNAを送り届けて異常を治す遺伝子治療は,難治性疾患を克服する技術として大きな期待を集めている。しかし,DNAは生体内に投与されると即座に分解されてしまうため,目的のDNAを疾患部位の標的の細胞まで確実に届けることができる,DNAの運び屋(ベクター)が必要となる。
現在,ベクターとしてはウイルスや,脂質をベースとした非ウイルス性の試薬が一般的に使用されている。だが,これらを生体に投与した場合,正常な細胞にも遺伝子が導入されてしまい,予期せぬ副作用を惹起してしまうことが懸念されていた。そのため,標的となる疾患部位だけに遺伝子を導入することができるベクターの開発が望まれていた。
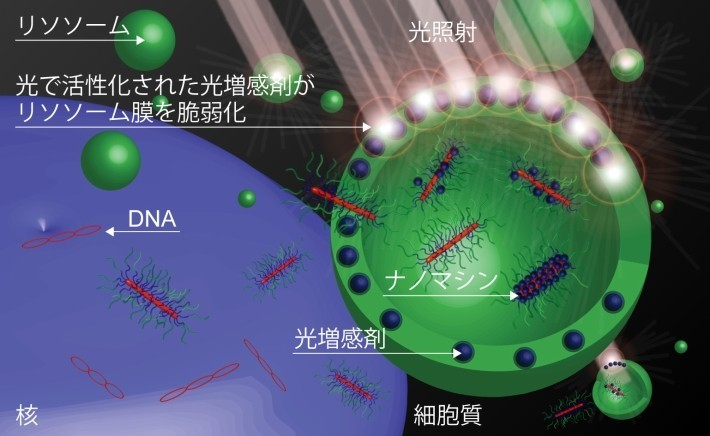
開発したナノマシンは,高分子とDNA,そして光で活性化すると活性酸素を産生する薬剤(光増感剤)の水中における自己会合により作製される。ナノマシンは,DNAを内包した内核層,光増感剤を内包した中間層,生体適合性材料の外殻層という三層構造を持ち,それぞれの層が効率的な遺伝子導入を行なうための機能を持っている。
ナノマシンは血中に投与されると,生体適合性外殻により生体物質の吸着を抑制し,さらにDNAを内核に閉じ込めておくことにより,DNAの分解を回避しながら血流中を循環する。がん組織の血管壁はナノスケールの穴が開いているため,ナノマシンがん細胞に取り込まれ,エンドソーム・リソソームと呼ばれる細胞の胃袋のようなものに運ばれる。
一般的にDNAそのものはそこから細胞質に移行することができないため,核まで到達することができない。そこで、ナノマシンは,エンドソーム・リソソーム内の酸性環境を検知して光増感剤を放出する。そこに光を当てて光増感剤を活性化すると,活性酸素が産生されてエンドソーム・リソソーム膜を壊し,DNAを細胞質に移行させることができる。
このナノマシンの機能により,培養がん細胞に対する遺伝子導入の実験では,光照射を行なうと遺伝子導入効率が100倍以上上昇することが確認された。さらに,皮下にがんを持つマウスにナノマシンを静脈注射した後,がんに光照射することにより,全身投与後の光選択的遺伝子導入に世界で初めて成功した。
今回の研究ではレポーター遺伝子を用いて光選択的遺伝子導入を実証したが,研究グループは将来的に治療用タンパク質をコードしたDNAをがん組織中の細胞に選択的に送り込み,その場で治療薬を生産することにより副作用を最小限にとどめた,低侵襲治療の実現が期待できるとしている。
関連記事「東大,光を照射した細胞に目的の遺伝子を導入するナノマシンを開発」「名大ら,細菌べん毛モーターが活性化するしくみを解明」































