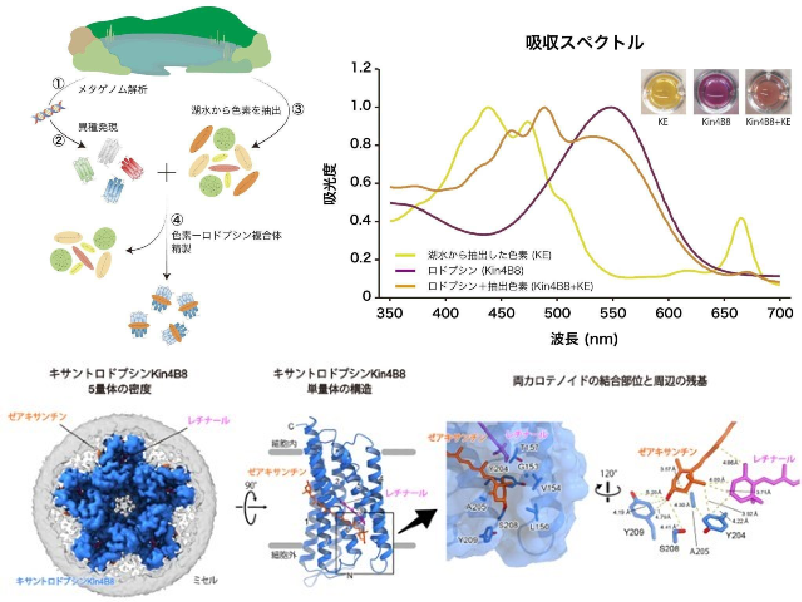
 北海道大学の研究グループは,海洋藻類Proteomonas sulcata由来の光受容体タンパク質であるアニオンチャネルロドプシン(PsuACR1)が,自らの輸送基質である塩化物イオン(Cl–)の濃度に応じて開口状態を変化させることを解明した(ニュースリリース)。
北海道大学の研究グループは,海洋藻類Proteomonas sulcata由来の光受容体タンパク質であるアニオンチャネルロドプシン(PsuACR1)が,自らの輸送基質である塩化物イオン(Cl–)の濃度に応じて開口状態を変化させることを解明した(ニュースリリース)。
生物が光を利用するプロセスには光受容体とよばれるタンパク質が関わっており,その中でもレチナールという色素をもつ光受容体タンパク質をロドプシンと呼ぶ。ロドプシンは人間を含む動物のほか微生物にも備わっており,その役割の解明やロドプシンを介した光利用が注目されている。
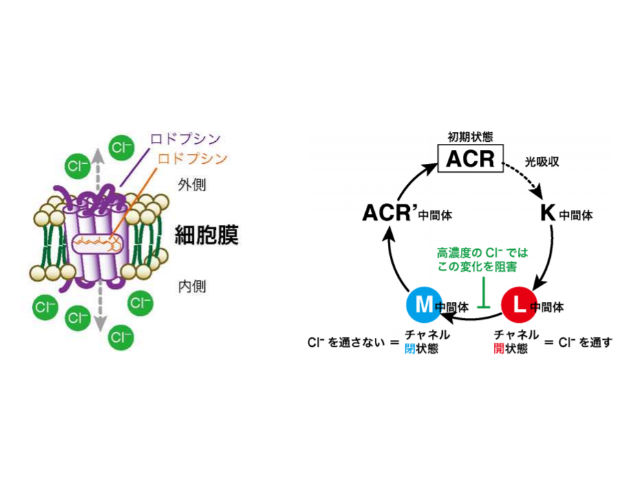
研究ではPsuACR1に着目。PsuACR1は,光に応答して開閉するチャネル機能をもっており,細胞膜内外の陰イオン濃度差にしたがって,陰イオンを受動輸送する。 特にPsuACR1はすばやいチャネル開閉を行なうことから,細胞応答の光操作技術(オプトジェネティクス)の新たなツール分子として注目されているが,すばやいチャネル開閉の詳しい動作メカニズムは明らかではなかった。
研究グループは,遺伝子組換え技術によってPsuACR1を調製し,紫外可視吸収分光法や時間分解吸収分光法などの計測法を用いて,輸送基質であるCl–がPsuACR1のチャネル開閉過程に与える影響を調査した。 その結果,光を受容する前の初期状態においてPsuACR1は分子の内部にCl–を結合することがわかった。
一方,光を受容したあとの状態では,Cl–濃度に依存してチャネルが閉じた状態の反応中間体の形成が阻害され,反対にチャネルが開いた状態の反応中間体の寿命が10倍長くなることを見出した。
この結果は,PsuACR1の輸送基質であるCl–が過剰なときには,PsuACR1の特徴であるすばやいチャネル開閉機能が損なわれることを意味する。
研究グループは,PsuACR1のチャネルが開いた状態の反応中間体が形成されるときに,過剰のCl–がPsuACR1の内部に流入し,捕捉されることにより,チャネルが閉じた状態の反応中間体を形成できなくなることが,すばやいチャネル開閉が損なわれた原因であると考察している。
今回の研究によって,PsuACR1は,高いCl–濃度下ではすばやい光操作ができないことが示唆された。これは,PsuACR1の類縁のACRタンパク質にも当てはまる性質である可能性があるという。研究グループはこの知見を活用し,幅広いCl–濃度範囲ですばやいチャネル開閉,すなわち,すばやい光操作を行なえるように改良したACRタンパク質の開発が期待されるとしている。