東京理科大学,大阪大学の研究グループは,テラヘルツ領域の自由電子レーザーを用いて,タンパク質のアミロイド線維を効果的に分解できることを世界で初めて明らかにした(ニュースリリース)。
タンパク質が繊維状に固まったものをアミロイド線維といい,生物の体内で異常に蓄積,沈着するとアミロイドーシスなどの重篤な疾患を引き起こすことが知られている。アミロイド線維をより詳しく見ると,βシートと呼ばれるシート状の構造が層状に重なっており,このシート構造が頑丈で水に溶けないために,アミロイド線維自体が分解されにくくなっている。
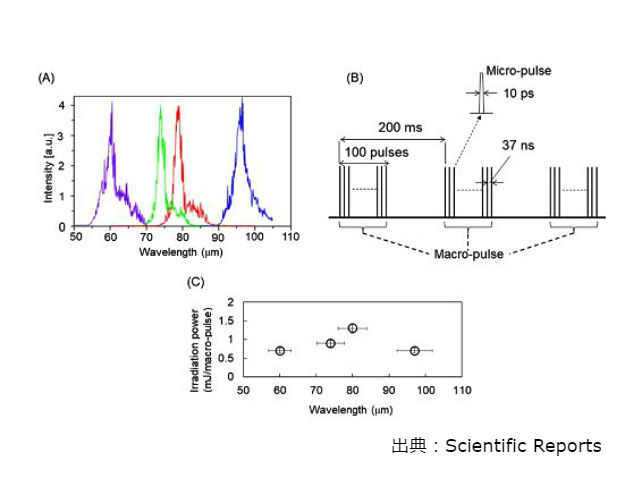
研究グループは,甲状腺ホルモンの一種カルシトニンのアミロイド線維に対し,FIR-FEL(波長約50~100μmの遠赤外線自由電子レーザー)とMIR-FEL(波長約5~10μmの中赤外線自由電子レーザー)を照射して照射効果を比較した。
カルシトニンを形成する32個のアミノ酸のうち,特に線維化しやすいことが明らかになっている5個のアミノ酸からなるペプチド(5種類のアミノ酸の頭文字を取り,DFNKFと呼ぶ)を材料としてアミロイド線維を作成し,平らなステンレス板上に薄いフィルム状に拡げた。このアミロイド線維のフィルムに対し,FIR-FELまたはMIR-FELを各30分間,およそ9000パルス照射して,何も照射せず温めたのみの場合と比較した。
FIR-FEL照射後のアミロイド線維フィルムを観察したところ,照射前と比べてβシート構造が半分程度に減少し,別の立体構造に変化していた。ペプチドサンプル全体に対するβシートの割合は,線維化していない正常なDFNKFペプチドと比べても顕著に低くなっていた。FIR-FELの照射位置にはレーザーのビームの太さとほぼ同等の直径を持つ丸い穴が開き,照射していない部分には影響がなかったこともわかった。
MIR-FELを照射したフィルムでも立体構造の変化が認められたが,βシートの減少はFIR-FELの場合と比べて緩やかなものにとどまった。レーザー照射を行なわず45℃から90℃に加熱したのみのサンプルでは,βシートは減少せず,線維化が進行していた。
今後研究チームはDFNKFに留まらず,他のペプチドのアミロイド線維についても,FIR-FELの効果の検証を予定しており,アルツハイマー病をはじめとするタンパク質の立体構造の変化をきっかけとする疾患の病態解明や治療の研究に弾みがつくことが期待されるとしている。